
▲第一作者:Sijun Pan, Yan Zhang
通讯作者:Huilin Shao
通讯单位:National University of Singapore
DOI: https://doi.org/10.1038/s41565-021-00872-w
背景介绍
目前用于测量药物和靶点相互作用的技术需要复杂的处理和侵袭性组织活检,限制了它们在癌症治疗监测中的临床应用。
本文亮点
1. 作者开发了一个分析平台,利用循环细胞外囊泡(EVs)对患者血液样本中肿瘤特异性药物靶点相互作用进行活性评估。
2. 该技术称为细胞外囊泡监测小分子化学occupancy和蛋白质表达(ExoSCOPE),利用生物正交探针扩增和匹配等离子体纳米环谐振器内分子反应的空间模式,原位分析EV的药物动力学。
3. 它测量EVs分子亚群中药物的占有率和蛋白质组成的变化。当用于监测各种靶向治疗时,ExoSCOPE显示EV信号,这些特征密切反映了细胞治疗的疗效,进一步应用于临床癌症诊断和治疗。
4. 利用少量血液,ExoSCOPE在治疗开始后24h内准确分类疾病状态并快速区分靶向治疗结果。
图文解析
药物(如小分子抑制剂)和靶点结合后,质膜蛋白受体(如表皮生长因子受体(EGFR))内化到细胞中。在EV生物发生过程中,蛋白质受体通过纳米级囊泡分泌到细胞外空间(图1a)。肺癌细胞(H3255)囊泡的多模态表征证实了其囊泡形态和分子组成,并证实了EVs中存在药物结合蛋白受体。因此,作者推断EVs可以作为药物动力学的反射循环生物标志物,并开发了ExoSCOPE平台来评估EV药物occupancy以及细胞治疗效果(图1a)。
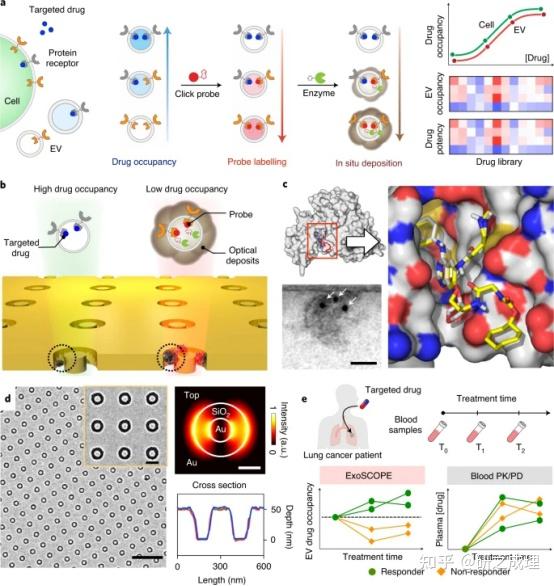
▲图1 ExoSCOPE用于EV药物动力学活性分析
在开发ExoSCOPE平台时,首先设计并合成了生物正交的click探针 (即A1、A2和A3)。
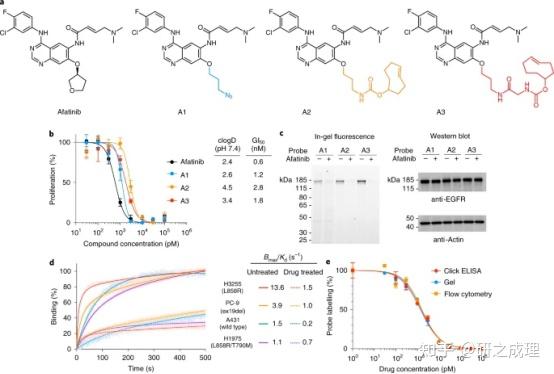
为了将A3探针应用于EV药物occupancy的分析,作者首先检测了它在整个EV中标记囊泡EGFR的能力。通过抗CD63捕获将EVs固定在微球上,并与探针A3孵育。多模式分析证实了afatinib竞争性探针标记囊泡EGFR(图3a);通过酶促不溶性光学产物的沉积证明了有效的探针扩增。接下来开发了空间优化的等离子体纳米环谐振器,用于局部测量EV探针标记(图3b)。
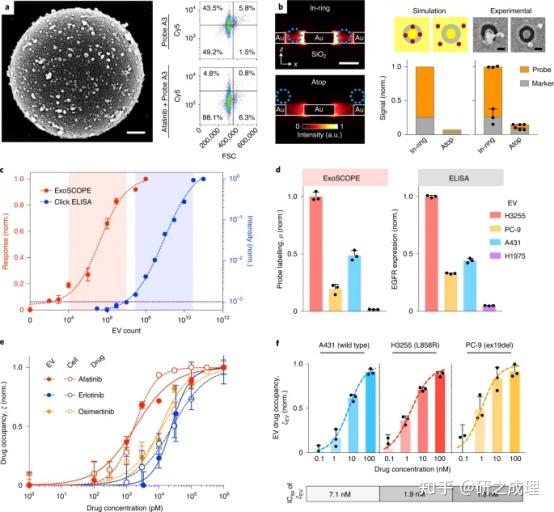
为了评估EV药物occupancy是否可以作为一种良好的循环生物标志物用于进行中的细胞治疗,即使是在异质细胞混合物中,作者开发了复合ExoSCOPE平台。利用靶向抑制剂处理细胞,并测量分泌型EV以及接受治疗的母细胞中的时间依赖性药物occupancy(图4a)。对于EV分析,开发了多重ExoSCOPE工作流程,通过使用不同的抗体来测量EVs分子亚群中的蛋白质组成和药物占有率。在细胞分析方面,使用流式细胞术来测量细胞标记物.
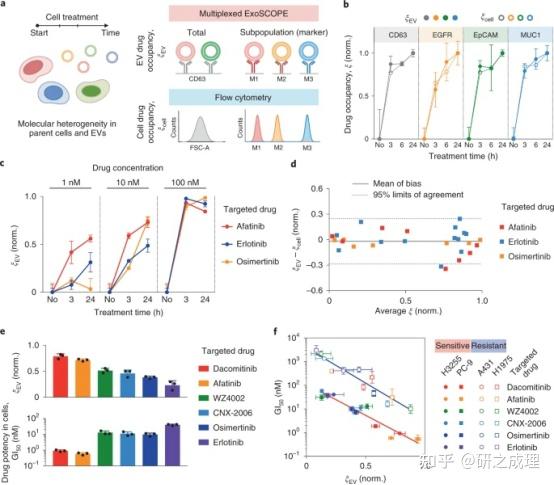
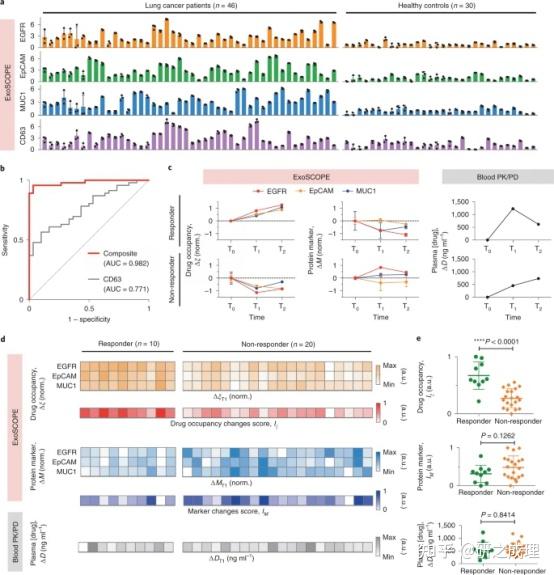
为了评估ExoSCOPE平台的临床应用,作者以肺癌为模型系统进行了可行性研究。目标:(1) 复合ExoSCOPE是否可以直接应用于临床血浆样本;(2) ExoSCOPE检测癌症患者的准确性;(3) ExoSCOPE显示的药物占用特征是否可以反映治疗效果。首先评估了ExoSCOPE平台的诊断能力,从肺癌患者和对照个体标志物(EGFR、EpCAM和MUC1)和一种EV标志物(CD63)进行了复合ExoSCOPE 分析(图5a)。进一步开发了一个基于肿瘤标志物ExoSCOPE分析的交叉训练回归模型,并使验证了该模型。与其他EV分析相比,ExoSCOPE显示了疾病分类的最佳准确性(图5b)。
为了评估治疗效果,作者应用多重ExoSCOPE检查EV药物占用的时间依赖性变化(图5c)。
原文链接:
https://www.nature.com/articles/s41565-021-00872-w作者简介

邵慧琳
邵慧琳,新加坡国立大学,NUS Presidential Young Professor;Institute for Health Innovation and Technology (iHealthtech),Principal Investigator。她的研究专注于开发基于集成纳米技术的平台,用于新型生物标志物的分子分析。她的工作发表在Nature Biotechnology, Nature Medicine, Nature Biomedical Engineering, Nature Communications等顶级期刊上,并被主流媒体报道。
主页:
https://www.huilinshao.com电话:13988888888
传 真:海南省海口市
手 机:0898-66889888
邮 箱:88889999
地 址:/public/upload/system/2018/07/28/2091301cca30ff8c6fd3ecd09c8d4b02.jpg